[칼럼] 수능 화학2 칼럼 Part 1
게시글 주소: https://test.orbi.kr/00055187756
안녕하세요! 이제 곧 개강이라 바빠지고 있어 글을 언제쯤 마무리할 수 있을지는 모르겠지만, 어떤 이유든지 화학2라는 과목을 선택하신 멋진 분들께 조금이나마 도움이 되고자 틈틈이 글을 작성해보겠습니다...! 엄청난 아싸라 생각보다 빠르게 작성할 수도...?
화학2를 선택하신 분들이라면 다들 아시겠지만, 이 과목은 개념이 상당히 적은 만큼 계산량이 엄청나다는 특성을 지니고 있습니다. 그렇기 때문에 개념을 확실히 잡는 것도 물론 중요하지만, 그보다는 문제를 어떻게 빠르고 효율적으로 풀이하는지가 고득점의 관건인 과목이라고 생각합니다.
사실 저도 화학2라는 과목의 고수라고 생각하지는 않지만, 3번의 수능 준비 및 응시를 통해 얻은 경험과 저만의 문제 풀이 방법 (다들 비슷하겠지만...!)을 공유하여 불모지와 같은 이 과목을 개척하기로 결정하신 분들께 조금이나마 도움이 되는 것이 이번 글의 목적입니다!
지난 물리1 관련 글과 마찬가지로, 문제를 예시로 사용해야 할 상황에서는 상대적으로 평이한 난이도였다고 평가 받는 2022학년도 수능과 역대급으로 어려웠다고 평가 받는 2022학년도 9평, 투과목 중에서 가장 높은 만점 표점을 자랑했던 2021학년도 수능 문제들을 활용하겠습니다.
* 양이 상당할 것 같아서, 세 개의 파트로 나눠서 작성할게요!
1. 개념
아시는 분은 다 아시겠지만, 저는 영재고-설공 코스를 통해 일반화학 이상의 베이스가 있는 상태에서 수능판에 발을 들였기 때문에 따로 개념을 공부하지는 않았습니다. 하지만 수능을 준비하면서 화학2와 관련된 정보를 많이 얻을 수 있었던 화학2갤러리에서 접한 바에 따르면, 개념 학습은 EBS에서 손은정T의 강의를 듣는 것이 가장 좋다고 합니다. 제가 느끼기에는 수능특강에 나름 필수적인 개념이 전부 포함되어 있어서, 많은 분들께서 추천하신 손은정T나 다른 인강 강사 분들의 강의를 통해 개념을 어느 정도 학습한 이후에, 수능특강에 있는 개념으로 점검 및 복습을 하는 것이 괜찮은 개념 공부 방법이라고 생각합니다.
화학2의 경우에는 개념의 양 자체가 많지 않기 때문에, 아래에서 단원별로 필수적인 개념 정도는 언급을 한 후에 저의 문제 풀이법을 소개 드리도록 하겠습니다! 그리고 주관적으로 생각하는 단원별 난이도도 10점 만점 기준으로 표기하겠습니다.
2. 기체 (난이도: 9/10)
○ 핵심 개념: PV=nRT (이상 기체 방정식), 부분 압력 법칙
화학2의 첫 단원이자 진입 장벽을 담당하고 있는 기체 파트입니다. 사실 순수하게 이 단원의 내용만 사용해서 풀이할 수 있는 문제는 거의 출제되지 않고, 출제되더라도 1, 2페이지 수준에 그치는 경우가 대부분입니다. 하지만 이 단원에 최고 난이도를 부여한 이유는, 다른 단원의 내용과 연계되어 출제될 가능성이 무궁무진하고 실제로 4페이지의 킬러 문제가 그런 방식으로 출제되는 경우가 많기 때문입니다. 보통 화학 반응과 연계되어 출제되는 경우가 많고, 넓게 보면 화학 평형이나 반응 속도 문제도 기체 파트의 내용이 직간접적으로 포함되는 경우가 대부분입니다. 그만큼 개념을 확실하게 잡고 넘어가야 할 파트인데, 그중에서도 가장 중요한 것이 바로 PV=nRT으로 표현되는 이상 기체 방정식과 '서로 반응하지 않는 혼합 기체의 전체 압력은 각 성분 기체의 부분 압력의 합과 같다'는 부분 압력 법칙입니다.
화학2에서 가장 중요한 공식이라고 해도 과언이 아닐 이상 기체 방정식은, 단순히 공식을 외우는 것보다 문제 상황에 따라 유연하게 공식을 변형해서 사용할 수 있도록 하는 것이 핵심입니다. 대표적인 변형 방식으로는 기체의 분자량을 계산하는 PM=dRT, 그리고 기체의 양을 계산할 때 n=PV/RT임에 착안해서 온도가 변하지 않는 상황이라면 기체의 몰수를 PV 형태로 표현하는 방식 등이 있겠네요. 부분 압력 법칙은 법칙의 내용 자체를 자연스럽게 받아들이면서 문제 풀이에 적용하는 것이 핵심인데, 보다 자세한 내용은 문제 풀이를 하면서 언급하겠습니다.
○ 대표적인 킬러 출제 내용: 온도, 부피, 압력 등의 조건 변화가 포함된 기체의 화학 반응
2022학년도 수능에서는 18번과 20번 문항 정도가 기체 파트 관련 문제로 출제되었다고 볼 수 있습니다. 2021학년도 수능에서는 상대적으로 난이도가 낮은 6번과 16번 문항이 기체 파트에서 출제되었구요. 이렇게 4문제와 더불어, 비주얼적으로 충격적(?)이었던 2022학년도 9평의 18번 문항까지 풀어보겠습니다.
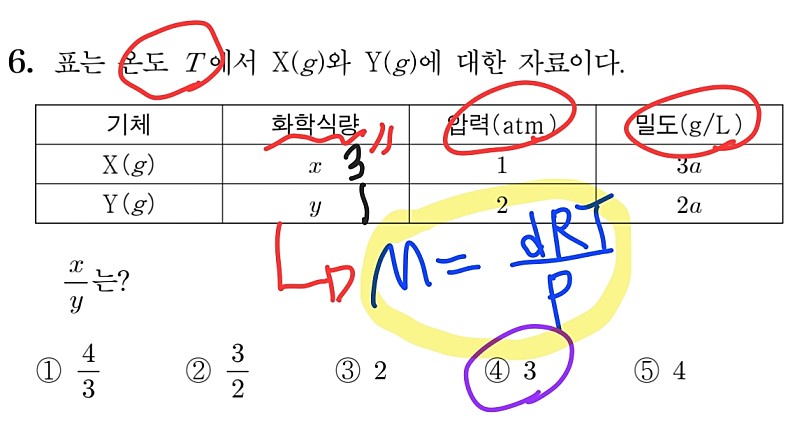
먼저 2021학년도 수능의 6번 문항입니다. 이 문제는 비킬러에 해당하지만, PV=nRT의 유연한 변형을 요구하는 대표적인 문제라는 점에서 살펴볼 가치가 있다고 판단하여 문제 풀이에 포함했습니다. 이 문제를 보자마자 화2러 여러분들은, 빨간 동그라미로 친 조건을 통해 화학식량을 구해야 한다는 점을 생각한 후, 바로 노란 동그라미의 식을 떠올렸어야 합니다. 사실 PM=dRT의 식이 워낙 유명하기 때문에 정말 쉬운 문제에 해당하지만, 이상 기체 방정식의 물리적 의미를 온전히 이해하시고 식이 어떤 식으로 변형될지 모른다는 점을 항상 염두에 두면서 문제에 접근하시길 바랍니다!

다음으로 2021학년도 수능의 16번 문항입니다. 배점이 3점이긴 하지만, 일반적인 4페이지의 2점 문항보다 쉬운 준킬러에 해당한다고 생각합니다. 화학2의 과목 특성 상, 타임어택이 굉장히 심하기 때문에 문제를 보자마자 빨간색으로 표시한 부분에 해당하는, 문제 상황의 핵심을 빠르게 파악하는 것도 중요한 요소입니다. 1)에 서술한 바와 같이, 문제에서 E가 생성되었다는 정보를 주었기 때문에 첫번째 반응의 한계반응물이 A임을 파악할 수 있습니다. 그리고 2)와 같이 n=PV로 취급 (따로 표시하지는 않았지만, 온도는 T로 일정하다는 괄호 안의 발문이 이처럼 취급할 수 있는 조건에 해당)하여, 용기 1에 들어있는 전체 기체의 양을 2P, B의 양을 x라고 놓습니다. 그러면 첫번째 반응이 완결되었을 때 남은 B와 C의 양이 3)과 같음을 파악할 수 있고, D가 모두 소모될 때까지 반응시켰다는 정보를 기반으로 두번째 반응이 완결되었을 때 남은 기체의 양을 구하면 B: 2x-2P-3, C: 4P-2x, E: 6이 됩니다. 마지막으로 반응이 완결된 후 E의 몰분율에 관한 정보를 활용하여 B와 C를 합한 양이 3임을 파악하고, 4)의 식을 통해 P=3임을 얻을 수 있습니다.

당시 출제된 적 없는 '분리막' 개념의 등장으로 인해 이슈가 되었던 문제, 2022학년도 9평의 18번 문항입니다. 사실 문제 자체가 엄청난 난이도를 갖고 있지는 않지만, 비교적 방대한 양의 발문과 생소한 개념의 등장으로 인해 체감 난이도는 상당히 높았을 것으로 예상됩니다. 이 문제도 발문 중에서 풀이에 필요한 핵심 내용을 파악하는 것이 중요한데, 제가 생각하기에는 발문에서 빨간색으로 표시한 부분들이 핵심입니다. 온도가 일정하기 때문에, 여기서도 n=PV 취급을 적극 활용합니다. 우선 A와 He가 1:2의 비를 가지므로, 1)과 같이 A는 V, He는 2V의 양임을 파악할 수 있습니다. 그리고 (다)의 상황을 보면, 반응이 완결된 후 C의 양이 V임을 알 수 있고 반응하지 않는 He는 1)의 양이 그대로 보존되어 2V이므로, 실린더 속 혼합 기체의 양이 대기압(1기압) X 실린더의 부피(3V)=3V임을 고려하면 A와 B가 모두 소모되었음을 알 수 있습니다. 이때 화학 반응식을 슬쩍 보면, 3)과 같이 V만큼의 C가 생성되기 위해서 B가 V/2만큼 반응해야 함을 알 수 있습니다. 이제 (라)의 상황을 보면, (다)에서 A가 모두 반응하였으므로 C와 He는 여전히 각각 V, 2V의 양이고 주어진 몰분율을 활용하면 실린더 속 전체 기체의 양이 11V/2임을 알 수 있습니다. 그러므로 B의 양은 전체 기체에서 C와 He의 양을 빼준 5V/2가 되고, 실린더 전체의 부피가 4V로 주어졌으므로 강철 용기의 부피는 4)와 같이 3V/2가 됩니다. 이렇게 구한 정보들을 바탕으로, 초기 B의 양과 강철 용기의 부피를 고려하여 5)와 같은 식을 세우면 x=2임을 얻을 수 있습니다.
글로 풀어 쓰니 풀이가 상당히 길어졌지만, 실제 시험장에서는 아래 사진 정도의 필기만을 진행하며 3분 안에 풀었어야 하는 문제라고 생각합니다. 화학 반응식에서의 a는 구할 필요가 없다는 것과 생소한 '분리막'의 개념이 사실상 아무 역할도 하지 않는다는 것이 이 문제의 함정 요소겠네요.

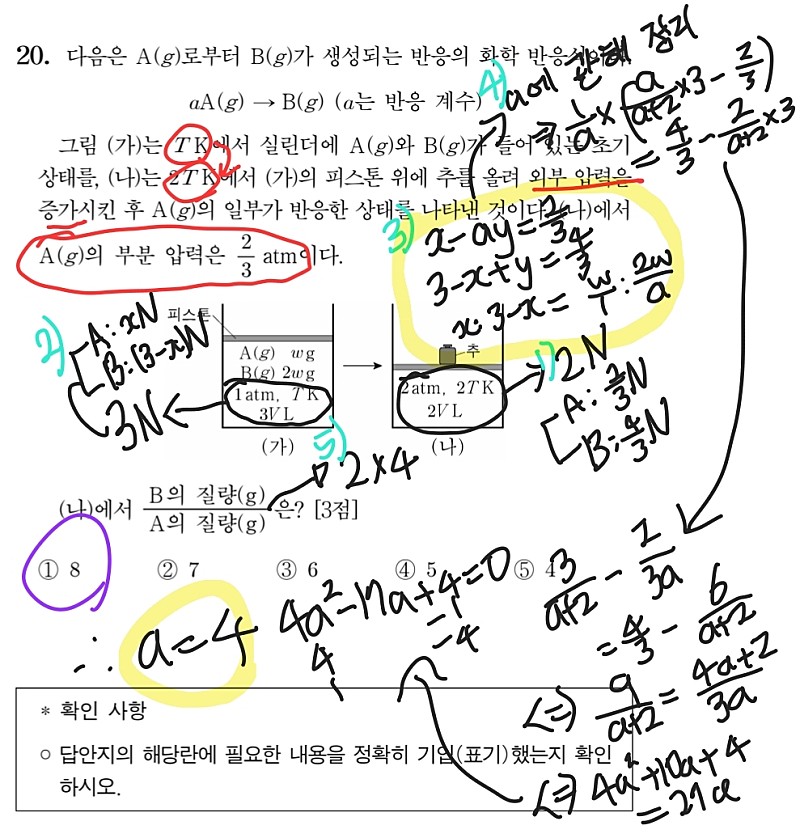
다음으로는 4페이지의 문제 답게 2점임에도 난이도가 꽤 있었던 2022학년도 수능 18번 문항입니다. 이 문제의 핵심은 (나) 과정 후와 (다) 과정 후의 He의 압력이 동일함을 근거로 화학 반응식에서 전체 기체의 양이 변하지 않는다는 것을 파악하는 것이라고 생각합니다. 이 생각을 하지 못했다면, 문제가 상당히 어렵게 느껴졌을 것입니다. 그럼 순서대로 살펴보겠습니다. 여기서도 n=PV로 취급합니다. 먼저 (가)의 그림에서 He의 양이 2이기 때문에, (나)의 결과와 종합하면 He의 압력이 5/2임을 알 수 있습니다. 고정 장치가 제거된 상황이기 때문에, 피스톤을 기준으로 양쪽의 기체는 압력이 같습니다. 그러므로 A와 B 모두 5/2의 압력을 갖고, 전체 실린더의 부피가 3L이기 때문에 1)과 같이 전체 기체의 양은 15/2, A와 B의 양의 합은 11/2가 됩니다. 이제 (다)의 결과를 보면, He의 압력이 변하지 않았으므로 꼭지를 연 이후 전체 실린더의 압력이 5/2로 유지된 상황이고, 이는 주어진 화학 반응식에서 기체의 양이 변하지 않을 때만 가능합니다. 그렇기 때문에 a=1임을 유추할 수 있고, A의 몰분율이 1/11임과 1)의 내용을 토대로 3)과 같이, 반응이 완결된 이후 A의 양이 1/2, 반응 전 초기 A와 B의 양이 각각 3, 5/2임을 알 수 있습니다. 따라서 A의 양이 3에서 1/2로 감소했으므로 비례식을 통해 최종 A의 질량이 w/6임을 알 수 있고, 혼합 기체가 차지하는 부피가 실린더 전체 부피에서 He가 차지하는 부피를 뺀 11/5이므로, 밀도의 정의를 활용하면 구하고자 하는 값은 5w/66이 나옵니다.

마지막으로 평가원에서 의도적으로 출제한 신유형이라고 생각되는 2022학년도 수능 20번 문항입니다. 화2러의 희망, 어나클 저자 분께서 참신하거나 효율적인 풀이를 공개적으로 구하셨던 문제기도 하죠. 저는 저의 계산 능력을 믿고 정공법으로 이 문제에 접근했습니다. 이 문제에서는 온도가 변화하기 때문에, 기체의 양을 n=PV/T 형태로 취급해야 하고 저는 1atm*L/T를 N이라고 놓았습니다. 이와 더불어 (나)에서의 A의 부분 압력이 2/3임을 활용하면, 1)과 같은 정보를 얻습니다. 그리고 (가)에서 A의 양을 xN이라고 놓으면 2)를 얻을 수 있고, 반응을 통해 생성된 B의 양을 yN이라고 하면 3)의 첫번째와 두번째 방정식을 얻습니다. 또, 화학 반응식의 계수 관계를 통해 알 수 있는 A와 B의 분자량 비 (1:a)와 (가)의 그림에서 주어진 A와 B의 질량 비 (1:2)를 활용하면 3)의 세번째 비례식을 얻을 수 있습니다. 이 연립방정식을 a에 관해 정리하고 풀이하면 4)의 다소 복잡한 계산 과정을 거쳐 a에 관한 이차방정식이 얻어지고, 반응식의 계수는 자연수여야 하므로 a=4의 해를 구할 수 있습니다. 마지막으로 5)와 같이 A와 B의 분자량 비, 몰수 비를 곱해 문제에서 요구하는 바를 구하면 8이 나옵니다.
화학2를 선택하기 위한 조건으로 뛰어난 계산력이 항상 언급되는 것처럼, 화학2 선택자 분들께서는 이렇게 정공법으로 정해진 시간 안에 많은 양의 계산을 수행하는 방법도 익히셔야겠습니다.

3. 액체와 고체 (난이도: 2/10)
○ 핵심 개념: 분자 간 상호작용, 수소 결합과 물의 특성, 액체의 증기 압력, 고체 결정의 종류와 구조
개인적으로 화학2에서 가장 쉬운 파트라고 생각합니다. 상당한 양의 계산이 요구되는 다른 파트와는 다르게, 개념의 단순 암기로 대부분의 문제가 해결되는 거의 유일한 파트이기 때문입니다. 그만큼 개념 학습을 확실히 해두는 게 중요한 파트이기도 합니다.
먼저 분자 간 상호작용의 경우에는 분산력, 쌍극자-쌍극자 힘, 수소 결합의 3가지가 존재하며 각각의 힘이 어떤 경우에 작용하는지 알아두어야 합니다. 일반적으로 수소 결합 >>> 쌍극자-쌍극자 힘 > 분산력의 세기 순서를 갖지만, 쌍극자-쌍극자 힘과 분산력의 경우에는 분자량이 비슷한 경우에 대한 비교만이 실질적인 의미가 있고, 분자량이 비슷한 무극성 분자의 경우 표면적이 더 큰 구조를 지닐수록 분산력이 크다는 점을 기억하시길 바랍니다. 그리고 분자 간 상호작용의 세기를 비교하기 위해서는 주로 '끓는점'을 사용합니다.
다음으로 수소 결합과 물의 특성에 대해서는, 얼음의 구조에 의한 일반적이지 않은 밀도의 경향성, 녹는점과 끓는점이 상당히 높다는 점, 상태 변화에 필요한 에너지 (융해열, 기화열, 증발열)가 크다는 점, 비열이 크다는 점, 표면 장력이 크다는 점, 수은과 대조되는 모세관 현상의 특성 등을 알고 계셔야 합니다.
액체의 증기 압력의 경우, 증발과 응축이 어떤 현상인지, 액체 표면에서 증발 속도는 일정하고 응축 속도는 시간이 지날수록 증가한다는 점, 그리고 증발 속도와 응축 속도가 같은 동적 평형 상태에 도달했을 때 증기가 갖는 압력으로 정의되는 증기 압력이 온도가 증가함에 따라 커진다는 점, 증기 압력 곡선과 끓는점 사이의 관계 등을 알고 계셔야 합니다.
마지막으로 고체 결정의 종류에 대해서는 결정성 고체와 비결정성 고체의 성질과 예시, 분자 결정, 원자 결정 (공유 결정), 금속 결정, 이온 결정의 물리적 특성에 대해 알고 계셔야 합니다. 또한 고체의 결정 구조에 대해서는 단위세포가 무엇인지, 단순 입방 구조, 체심 입방 구조, 면심 입방 구조의 여러 가지 특성 (단위세포의 형태, 단위 세포 당 입자 수, 한 입자를 둘러싸고 있는 가장 가까운 입자 수 등)에 대해 알고 계셔야겠습니다.
○ 대표적인 비킬러/준킬러 출제 내용: 핵심 개념과 동일
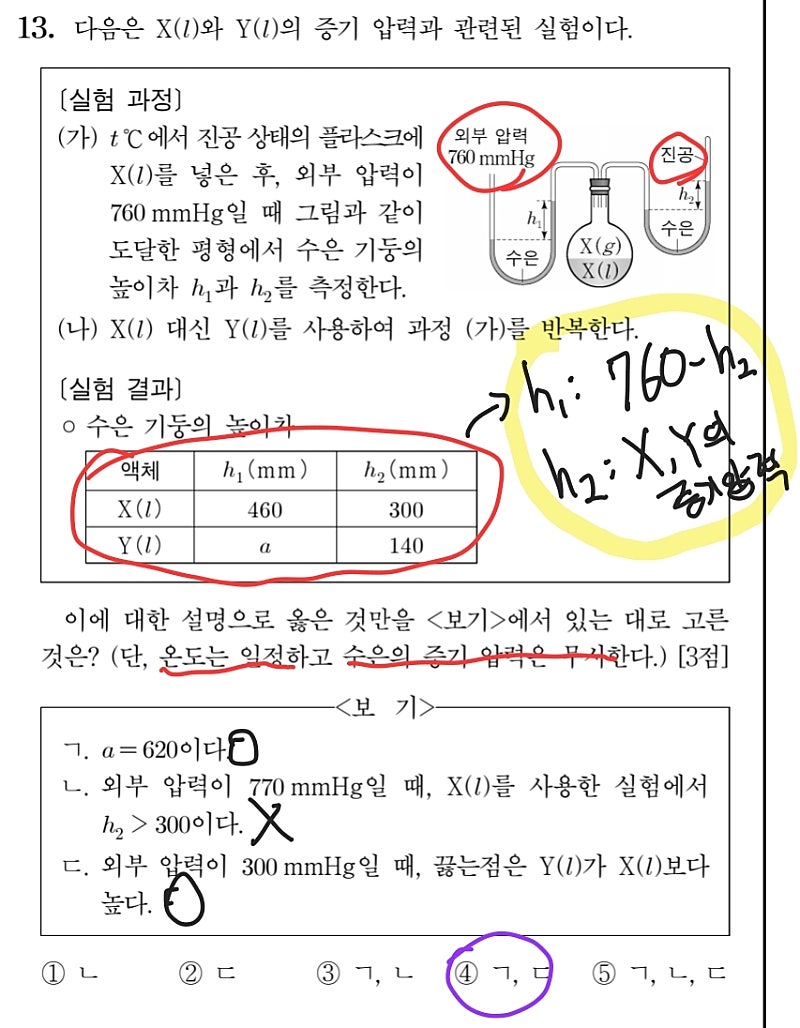
화학2에서 유일하게 비킬러로만 구성된 1페이지에 단골로 출제되는 파트입니다. 실제로 2022학년도 수능의 경우, 1번, 2번, 8번, 13번 정도가 이 파트와 관련하여 출제되었습니다. 앞에서 말씀드린 바와 같이 개념의 단순 암기로 대부분의 문제가 해결되기 때문에, 수은 기둥의 높이차와 증기 압력 사이의 관계와 관련된 13번 정도만 풀어보고 다음 파트로 넘어가겠습니다.
풀이가 상당히 간결한 것에서 알 수 있듯이, 개념만 확실히 알고 있으면 쉽게 풀 수 있는 문제입니다. 여기서 U자형 관이 있을 때 양쪽의 수은 기둥의 높이차가 양쪽에 있는 기체 (존재한다면) 사이의 압력 차이임과 서로 다른 두 물질의 끓는점의 대소 관계는 외부 압력이 어떤 값을 가지든지 변하지 않는다는 점 (최소한 화학2 수준에서는 참인 명제) 정도가 짚고 넘어갈 만한 포인트입니다. 따로 풀이 관련 서술은 하지 않겠습니다.

4. 용액 (난이도: 6/10)
○ 핵심 개념: 여러 가지 농도의 정의와 특성, 농도의 변환, 묽은 용액의 총괄성 (증기 압력 내림, 끓는점 오름, 어는점 내림, 삼투압 각각의 정의와 활용)
화학2에서 은근히 복병을 담당하고 있다고 생각하는 용액 단원입니다. 내용 자체는 크게 어렵지 않은데, 농도의 변환이나 끓는점 오름 등의 계산 과정이 긴 편에 속하다 보니 계산 실수를 할 가능성이 높은 것 같아요ㅜㅜ 그래서 이 파트에서는 여러 가지 농도의 정의와 특성을 잘 기억하고 있는 것, 총괄성에 해당하는 현상들의 정의를 잘 기억하고 있는 것도 중요하지만, 계산을 꼼꼼히 하는 것도 그만큼 중요하다고 생각합니다.
구체적으로 들어가면, 다음과 같은 정의를 정확하게 기억하고 계셔야 합니다. 각각의 특성에 대해서도 개념 교재를 통해 충분히 학습하셔야 하구요! 농도의 변환을 공식처럼 암기하는 경우가 있는데, 각각의 농도의 정의를 정확하게 이해하고 있으면 농도의 변환은 단순 계산일 뿐입니다. 개인적으로 굳이 암기할 내용을 늘릴 필요는 없다고 생각해서, 스스로 농도의 변환 과정을 유도하는 연습을 많이 해보는 것을 추천합니다!
- 퍼센트 농도(%)=100*용질의 질량(g)/용액의 질량(g)
- ppm 농도=(10^6)*용질의 질량(g)/용액의 질량(g)
- 몰 농도(M)=용질의 양(mol)/용액의 부피(L)
- 몰랄 농도(m)=용질의 양(mol)/용매의 질량(kg)
- 몰 분율 (X, 균일 혼합물)=특정 성분의 양(mol)/혼합물의 전체 양(mol)
- 증기 압력 내림=용매의 증기 압력 - 용액의 증기 압력
- 라울 법칙 (묽은 용액): P_용액=P_용매 * X_용매
- 끓는점 오름 (비휘발성&비전해질 용질, 묽은 용액)= K_b(몰랄 오름 상수) * m
- 어는점 내림 (비휘발성&비전해질 용질, 묽은 용액)= K_f(몰랄 내림 상수) * m
- 삼투: 반투막을 통해 농도가 묽은 용액의 용매 분자가 농도가 더 진한 용액 쪽으로 이동하는 현상
- 반트호프 법칙 (비휘발성&비전해질 용질, 묽은 용액): 삼투압=CRT (C: 몰 농도)
○ 대표적인 준킬러 출제 내용: 농도의 변환 응용, 증기 압력 내림 (or 끓는점 오름이나 어는점 내림) 응용
이 파트에서 출제되는 문제는 대부분 준킬러 정도의 난이도를 갖고 있다고 생각하시면 됩니다. 실제로 2022학년도 수능에서도 9번과 10번 문항이 이 파트 관련 내용으로 출제되었습니다. 이 파트 관련 문제로는 2022학년도 수능의 9번 문항, 2022학년도 9평의 15번 문항, 그리고 2021학년도 수능의 14번 문항을 풀어보도록 하겠습니다.
먼저 2022학년도 수능의 9번 문항입니다. 몰 농도와 몰랄 농도 사이의 변환을 연습해볼 수 있는 좋은 문제죠. 따로 풀이를 설명할 것이 없을 정도로 간단한 문제이지만, 농도의 변환 관련 문제는 보통 이 문제와 비슷한 형태로 출제된다는 점, 그리고 계산의 난이도에 차이가 있을 뿐 기본적인 변환의 원리는 각 농도의 정의 활용이라는 점을 기억하시길 바랍니다.

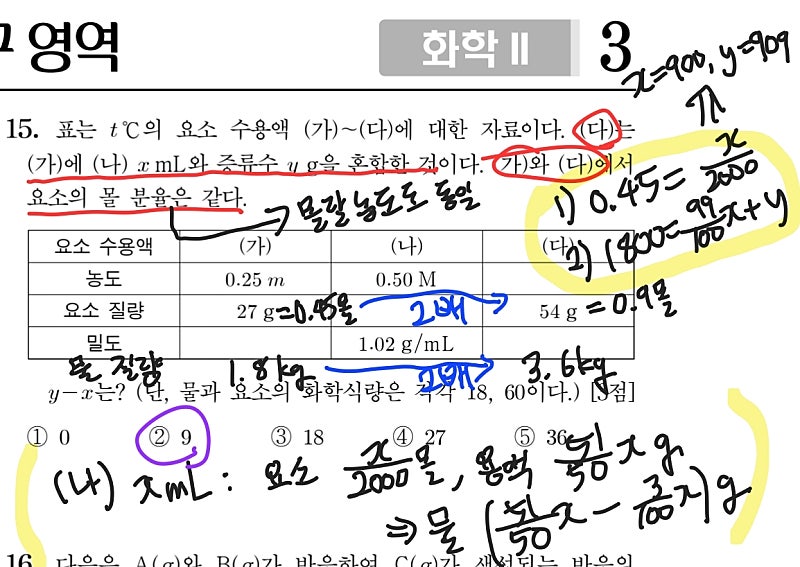
다음으로는 2022학년도 9평의 15번 문항입니다. 3페이지에 있고 3점의 배점을 받은 만큼, 난이도가 조금 있는 문제입니다. 가장 먼저 파악해야 할 것은 (가)와 (다) 모두 같은 용질과 용매로 구성된 용액이기 때문에, 발문에 제시된 조건, 두 용액에서 요소의 몰 분율이 같다는 것이 곧 두 용액의 몰랄 농도가 동일하다는 명제와 동치라는 것입니다. 그렇기 때문에 표의 세번째 행에서 요소 질량이 (다)가 (가)의 2배인 것을 확인하면, 용매에 해당하는 물의 질량도 (다)가 (가)의 2배가 되는 것이죠. TMI로 과학적인 용어를 사용하면, 세기 성질인 농도가 같으므로 크기 성질인 용액의 부피, 용질의 질량, 용매의 질량 등이 모두 같은 비례 관계를 갖는 상황입니다. 아무튼 이렇게 (가)와 (다)의 관계를 파악한 후, 발문의 첫번째 밑줄을 (다)=(가)+(나) xmL + 증류수 y g --- 3) 의 등식 으로 바꿉니다. x와 y의 값을 구해야하기 때문에, (나) xmL가 어떻게 구성되어 있는지 표의 정보를 바탕으로 선지 아래의 노란 괄호처럼 파악합니다. 그러면 이제 3)의 등식을 요소 질량에 관한 등식 1)과 물의 질량에 관한 등식 2)로 노란 동그라미와 같이 쪼개면, x와 y를 구할 수 있습니다.

마지막으로 2021학년도 수능의 14번 문항입니다. 사실 이 문제는 어나클에 굉장히 잘 설명되어 있으니, 더 자세한 내용은 어나클 교재를 참고하시길 바랍니다. 이 문제의 핵심은 끓는점 오름을 구하는 공식에서 다른 조건이 변하지 않는다면, 끓는점 오름의 크기가 용매의 질량에 반비례한다는 점을 활용하는 것입니다. 이를 그래프에 주어진 정보와 함께 활용하면, 선지의 아래에 서술한 바와 같이 (가)와 (나)에 들어있는 초기 물의 질량을 각각 구할 수 있습니다. 그러고 나서, A와 B의 화학식량 비와 그래프에서 (가)와 (나)가 만나는 지점에서의 정보를 활용하여 발문의 왼쪽에 서술한 바와 같은 등식을 세우면 문제에서 요구하는 x를 바로 구할 수 있습니다. 어나클 저자 분께서 교재에 설명하신 것처럼, 화학2에서는 비례 또는 반비례 관계를 활용하여 필요한 숫자를 빠르게 구하는 것과 발문 또는 그래프로부터 적절한 정보를 선택하여 문제 풀이에 활용하는 것이 빠르고 정확한 문제 풀이를 위해 요구되는 핵심 능력이라고 생각합니다.


확실히 태블릿의 키보드 북커버 케이스가 도착하니 글을 작성하는 게 훨씬 수월하네요. 컨텐츠 부족, 응시 인원 수 적음 등의 이유로 화학2라는 과목에 애정이 있어서 그런지, 다른 과목보다 글을 더 알차게(?) 쓰게 되는 것 같네요ㅋㅋㅋ 다음 글도 멀지 않은 시일 내에 마무리할 수 있도록 노력하겠습니다!
0 XDK (+0)
유익한 글을 읽었다면 작성자에게 XDK를 선물하세요.
-
ㅎㅎ 안녕하시긔 2
ㅎㅎ
-
이번에 수학 확실하게 잘 보고 싶은데 뭐가 더 좋을까요 개인적으로 자이나 마더텅 안...
-
스팀 게임 추천 좀 60
사펑, 엘든링 안 받음
-
사실 오르비쿨라리스임
-
개추 눌렀어요
-
어제부터 신경쓰였는데 오늘은 좀 많이 역하네
-
ㅋㅋㅋㅋ 170이에여 응애
-
일로와
-
ㅎㅎㅎㅎㅎ
-
의문사가 꽤 많네요ㅜㅜ 역시 국어는 이제 놔주는걸로
-
수1 수2 미적중 하나를 듣는다면 뭐가좋을까요???
-
아주대 93~94 99 1 99 99 > 5칸 연세대 98 99 1 99 99 >...
-
ㅠㅠㅠㅠㅠ무관이에요
-
책임소재보단 피해 유족들에 대한 2차가해부터 먼저 해결해야 한다고 봄 8
항공사고 영상 올리는 유튜버분 커뮤니티에서 퍼왔습니다
-
존잘남 특징 쓰기 ㄱㄱ
-
사학vs일문인데 자꾸 고민이네 외대 사학과는 4칸 5칸 왔다갔다 하긴하는데;;; 님들이라면 뭐함
-
미적 3이면 0
문제집 뭐가 좋을까요? 현역때 6 재수해서 3 으로 올라와서 수학문제집은 잘...
-
음.......내가 한국인이라 한국 뉴스만 보이는건가
-
1학기 무휴반->2학기 휴반 으로 반수할건데 작년에 김승리 커리 탔었거든요....
-
이정도면 표본 분석 안해도 되겠죠
-
여자친구 키 8
각자 어느정도가 좋음..?
-
국민대 자유전공이 올해 처음 개설되는데, 진학사 기준으로는 6칸 (최초합격) 으로...
-
뭐의 초성임뇨?
-
ㅠㅜㅜ
-
아직도 어디 쓸지 확실하게 못정함..
-
걍 안정 6칸 이상 하나 박는게 맞는거 같기도 함.. 지금 355 쓰려고 하고...
-
애플펜슬 펜촉 6
다들 애플펜슬 기본 펜촉 쓰시나요? 기본 펜촉 미끌거리는 게 싫어서 펜촉 바꿔보려고...
-
둘 다 개념은 알고있어서 아직도 못 고르는중..
-
화1생1 골랏던 07현역임니다 인설의가 가고싶은데 수학은 수능 100인데 국어...
-
2. 정치 커뮤 아닌 데에서 특정 정당을 매도(매수의 반댓말 아님.)하는 사람은...
-
정시 원서 사진 0
혹시 정시 원서 사진 규격이 어떻게 되나요?? 수능 원서 쓸 때 썼던 사진 써도 될까요??
-
새벽에 깨어날듯
-
반수생이라 매월승리 4호부터 풀려하는데 작년에 4호부터 살 수 있게 나왔었나요??...
-
문과 입장에서 어디가 좋을까요 취업엔 산공이 좋아보이는데 사탐공대라 뒤쳐질꺼같고
-
뭐가 더 좋음?
-
해설서 읽을때 문법 용어 하나도 몰라서 해설서 자체를 이해못하는데 일리 괜찮을까요?
-
사고원인이 위치랑 규모다 -> 씹소리 에휴
-
칸수 높 -> 낮? 칸수 낮 -> 높?
-
00인데 19수능 때 강민철 풀커리로 현강들음 이젠 여기에 강민철 현강만 하던 시절...
-
연근 브로콜리 김에다 밥 먹는다는데 ㄹㅇ몬맛으로먹는거
-
본인 성별 14
뭘거 같나요 ㄹ흐ㅡㅎ
-
기하 쎈 샀당 4
돌이킬 수 없는 강을 건너는 배를 만드는 중
-
침대에 누워서 보게 제발
-
가능? ㅎ
-
따잇하면 기분좋아져
-
ㅈㄱㄴ
-
진학사 5칸인데 1
안정카드로 가능할까요? 다군이고 광명상가 인가경라인입니다 30명 언저리 뽑고...
-
어뜨캐
-
[속보]탑승객 181명 중 사망 176명·생존 2명·실종 3명 5
29일 오전 전남 무안국제공항에 추락한 제주항공 7C2216편의 사망자 수가...
-
지금은 중간1~높2 정도인듯.. 김범준 스블은 듣고싳어서













































화2추추추화2는 신입니다.
화2 무지성 개추
화2 ㄷㄷ

화2 칼럼 존버 성공화2 선택자 가산점 기원합니다.
화2 깡표로 설의 정문 폭파하고 싶네요 ㅋㅋㅋ
ㅋㅋㅋㅋ 지금처럼 고인 표본에서 문제가 얼마나 괴랄하게 나와야 표점 대박이 날지 상상이 안 가네요...
투과목 칼럼은 내가 안 해도 일단 7H추

선생님 칼럼 보고 화2 치러 갑니다 파이팅화2러 화이팅!!
ㄱㅅㅎㄴㄷ
기체가 9점이라니... 그럼 10점은 평형 상수인가요, 아니면 반응속도인가요?
개인적으로 평형 파트라고 생각합니다...! 반응 속도 킬러는 무지성 거듭제곱 나열이 잘 먹히는 경우가 많아서요ㅋㅋㅋㅋ
21 수능 생각하면 확실히 평형이 더 어려운것 같긴 하네요. 기체 + 평형 조합이 제일 힘들어...
그쵸 사실 평형이나 반속 파트 모두 기체 파트가 녹아 있어서... 중요도 자체는 기체 파트가 가장 큰 것 같아요
화학2 혼자 공부하느라 힘들었는데 너무 감사합니다!!
형님 화1 중화, 양적관계가 잘 안되어있고(킬러) 풀더라도 스킬 몰라 식 노가다로 조져서 푸는데 화2 수능준비하는데 지장 있나요?
음 산염기에서 킬러가 출제된 적이 아직 없어서 중화 파트는 조금 부족해도 괜찮을 것 같은데, 양적 관계는 스킬과 관계 없이 '빠르게' 해결할 수 있을 정도로는 연습하시는 게 좋을 것 같아요! 화2는 정말 속도가 핵심인 과목이라...
저 그 제가 화2 하이탑 가지고 있는데, 인강없이 혼자 책만 보고 공부할려고 하거든요. 하이탑을 제대로만 본다면 개념 모르는건 없을테고, 문풀이 문젠데.. 화2는 인강에서 알려주는 스킬같은게 있는지 궁금하고, 있다면 이 스킬을 알고 있는게 실전 문풀에서 중요한지 궁금합니다.
저도 화2 인강을 안 들어봐서 잘 모르겠는데, 실전 문풀에 필요한 스킬(?)은 어나클 보시면서 기출과 실모로 연습하시면 충분히 습득할 수 있다고 생각합니다!
이글을 왜 이제야 본거죠 으아악 이런 글 찾고 있었는데 감사합니다 ㅠㅠ
뜬금없이 질문 드려도 될진 모르겠지만 기출 앞에서부터 쭉쭉 풀어나가다 보니 화학반응이 들어간 기체파트에서 벽느껴지는데 스스로 생각할 수 있을때까지 반복노출 하는게 맞는지 어느정도 해설 보는걸 타협하면서 가야할지 궁금합니다.. 조언 구할 수 있을까요..?
답변이 늦었네요ㅜㅜ 킬러 파트에 해당하는 부분은 어느 정도 해설을 볼 필요가 있다고 생각합니다! 아무리 생각해도 좋은 풀이가 떠오르지 않는 경우가 있거든요... 대신에 해설을 통해 특정 유형에 해당하는 풀이 방법을 접했다면, 그 유형의 문제는 본인이 해설에서 제시한 풀이 방법을 자연스럽게 사용할 수 있을 정도로 해설 없이 스스로 푸는 연습을 해야겠죠!?

답변 감사합니다!!!상대적으로 여유가 있는 지금은 조금 생각하는 텀을 가지고는 있는데 확실히 아예 발상조차 안되는 것들은 해설을 통해 공부하고 체화하는 방향으로 가야겠네요 ㅠㅠ 바쁘실텐데 다시 한번 감사드립니다@@